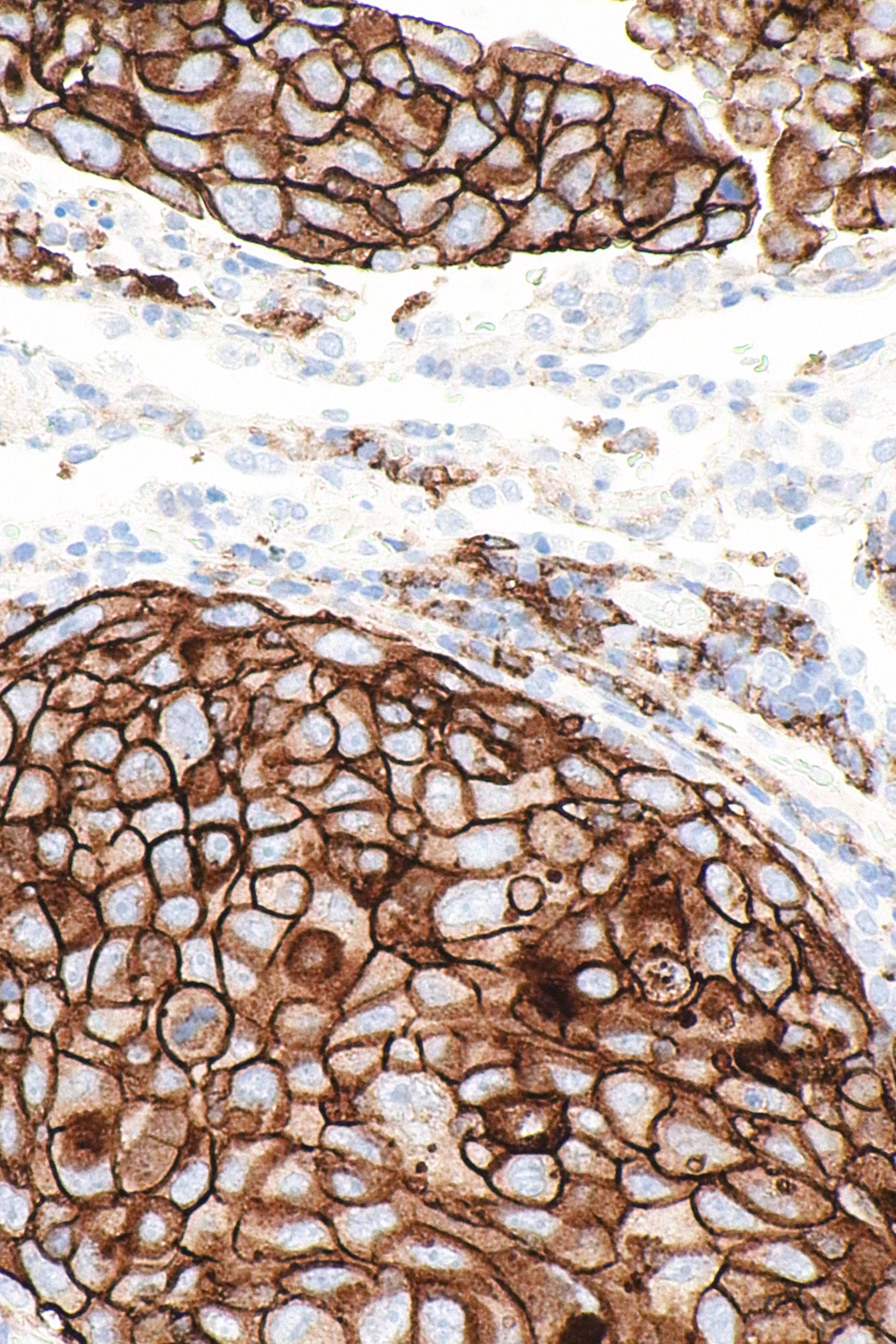
Wat zijn PD-1-remmers en PD-L1-remmers?
PD-1-remmers en PD-L1-remmers zijn een groep van checkpoint-remmers tegen kanker die de activiteit van PD-1- en PDL1-immuuncontrolepunt-eiwitten op het oppervlak van cellen blokkeren. Immuuncontrolepuntremmers zijn in opkomst als eerstelijnsbehandeling voor verschillende soorten kanker.
PD-1- en PD-L1-remmers werken om de associatie van de geprogrammeerde dood-ligand 1 (PD-L1) met zijn receptor, geprogrammeerde celdood-proteïne 1 (PD-1), te remmen. De interactie van deze celoppervlakte-eiwitten is betrokken bij de onderdrukking van het immuunsysteem en treedt op na infectie om het doden van omstandige gastheercellen te beperken en auto-immuunziekten te voorkomen. Dit immuuncontrolepunt is ook actief tijdens de zwangerschap, na weefseltransplantaties en bij verschillende soorten kanker.
| Naam | Doelwit | Goedgekeurd |
|---|---|---|
| Nivolumab | PD-1 | 2014 |
| Pembrolizumab | PD-1 | 2014 |
| Atezolizumab | PD-L1 | 2016 |
| Avelumab | PD-L1 | 2017 |
| Durvalumab | PD-L1 | 2017 |
| Cemiplimab | PD-1 | 2018 |
Geschiedenis
Het concept van het blokkeren van PD-1 en PD-L1 voor de behandeling van kanker werd voor het eerst gepubliceerd in 2001. Farmaceutische bedrijven begonnen met het ontwikkelen van medicijnen om deze moleculen te blokkeren, en de eerste klinische proef werd gelanceerd in 2006, waarbij nivolumab werd geëvalueerd. Sinds 2017 zijn er meer dan 500 klinische onderzoeken met PD-1- en PD-L1-remmers uitgevoerd bij meer dan 20.000 patiënten. Eind 2017 waren PD-1 / PD-L1-remmers goedgekeurd voor de behandeling van negen vormen van kanker.
Immunotherapie bij kanker
In de ziektetoestand van kanker vermindert de interactie van PD-L1 op de tumorcellen met PD-1 op een T-cel T-celfunctiesignalen om te voorkomen dat het immuunsysteem de tumorcellen aanvalt. Het gebruik van een remmer die de interactie van PD-L1 met de PD-1-receptor blokkeert, kan op deze manier voorkomen dat de kanker het immuunsysteem ontwijkt. Verschillende PD-1- en PD-L1-remmers worden in de kliniek uitgeprobeerd voor gebruik bij onder meer gevorderd melanoom, niet-kleincellige longkanker, niercelcarcinoom, blaaskanker en Hodgkin-lymfoom.
Immuuntherapie met deze immuuncontrolepuntremmers lijkt tumoren te doen krimpen bij een groter aantal patiënten over een breder scala aan tumortypen en gaat gepaard met lagere toxiciteitsniveaus dan andere immuuntherapieën, met duurzame responsen. De novo en verworven resistentie wordt echter nog steeds gezien bij een groot deel van de patiënten. Vandaar dat PD-L1-remmers worden beschouwd als de meest veelbelovende geneesmiddelencategorie voor veel verschillende kankers.
Niet alle patiënten reageren op PD-1 / PD-L1-remmers. De FDA heeft verschillende testen goedgekeurd om het niveau van PD-L1 te meten dat tot expressie wordt gebracht door tumorcellen, om de waarschijnlijkheid van respons op een remmer te voorspellen. PD-L1-niveaus bleken in hoge mate voorspellend te zijn voor de respons. Een hogere mutatiebelasting is ook voorspellend voor de respons op anti-PD-1 / PD-L1-middelen.
PD-1- en PD-L1-remmers zijn nauw verwant aan CTLA4-remmers (cytotoxische T-lymfocyt-geassocieerde proteïne 4), zoals ipilimumab. PD-1 en CTLA-4 worden beide tot expressie gebracht op geactiveerde T-cellen, maar in verschillende fasen van immuunrespons.
Huidige klinische onderzoeken evalueren anti-PD-1- en PD-L1-geneesmiddelen in combinatie met andere immunotherapie-geneesmiddelen die LAG3, B7-H3, KIR, OX40, PARP, CD27 en ICOS blokkeren.
Therapeutica
PD-1
Pembrolizumab (voorheen MK-3475 of lambrolizumab, Keytruda) is ontwikkeld door Merck en voor het eerst goedgekeurd door de Food and Drug Administration in 2014 voor de behandeling van melanoom. Het werd later goedgekeurd voor uitgezaaide niet-kleincellige longkanker en plaveiselcelcarcinoom in het hoofd-halsgebied. In 2017 werd het het eerste immunotherapie-medicijn dat werd goedgekeurd voor gebruik op basis van de genetische mutaties van de tumor in plaats van de plaats van de tumor. Er werd aangetoond dat patiënten met een hogere niet-synonieme mutatiebelasting in hun tumoren beter reageren op de behandeling. Zowel hun objectieve responspercentage als progressievrije overleving bleken hoger te zijn dan bij patiënten met een lage niet-synonieme mutatiebelasting.
Nivolumab (Opdivo) is ontwikkeld door Bristol-Myers Squibb en voor het eerst goedgekeurd door de FDA in 2014 voor de behandeling van melanoom. Het werd later goedgekeurd voor plaveiselcel-longkanker, niercelcarcinoom en Hodgkin-lymfoom.
Cemiplimab (Libtayo) is ontwikkeld door Regeneron Pharmaceuticals en voor het eerst goedgekeurd door de FDA in 2018 voor de behandeling van cutaan plaveiselcelcarcinoom (CSCC) of lokaal gevorderd CSCC die geen kandidaat zijn voor curatieve chirurgie of curatieve straling.
Experimenteel
Momenteel zijn er veel PD-1-remmers in ontwikkeling:
- JTX-4014 door Jounce Therapeutics Vanaf 2020 Fase I-studie gestart
- Spartalizumab (PDR001) is een PD-1-remmer die door Novartis is ontwikkeld voor de behandeling van zowel solide tumoren als lymfomen, die vanaf 2018 fase III-onderzoeken zijn gestart.
- Camrelizumab (SHR1210) is een anti-PD-1 monoklonaal antilichaam geïntroduceerd door Jiangsu HengRui Medicine Co., Ltd. dat onlangs voorwaardelijke goedkeuring heeft gekregen in China voor de behandeling van recidiverend of refractair klassiek Hodgkin-lymfoom.
- Sintilimab (IBI308), een menselijk anti-PD-1-antilichaam ontwikkeld door Innovent en Eli Lilly voor patiënten met niet-kleincellige longkanker (NSCLC).
- Tislelizumab (BGB-A317) is een gehumaniseerd IgG4 anti-PD-1 monoklonaal antilichaam in klinische fase 3- en fase 2-cruciale onderzoeken bij solide tumoren en hematologische kankers.
- Toripalimab (JS 001) is een gehumaniseerd IgG4 monoklonaal antilichaam tegen PD-1 in klinisch onderzoek.
- Dostarlimab (TSR-042, WBP-285) is een gehumaniseerd monoklonaal antilichaam tegen PD-1 dat wordt onderzocht door GlaxoSmithKline
- INCMGA00012 (MGA012) is een gehumaniseerd IgG4 monoklonaal antilichaam ontwikkeld door Incyte en MacroGenics.
- AMP-224 door AstraZeneca / MedImmune en GlaxoSmithKline
- AMP-514 (MEDI0680) door AstraZeneca
PD-L1
Atezolizumab (Tecentriq) is een volledig gehumaniseerd IgG1 (immunoglobuline 1) antilichaam ontwikkeld door Roche Genentech. In 2016 keurde de FDA atezolizumab goed voor urotheelcarcinoom en niet-kleincellige longkanker.
Avelumab (Bavencio) is een volledig menselijk IgG1-antilichaam ontwikkeld door Merck Serono en Pfizer. Avelumab is door de FDA goedgekeurd voor de behandeling van gemetastaseerd merkelcelcarcinoom. Het faalde klinische fase III-onderzoeken voor maagkanker.
Durvalumab (Imfinzi) is een volledig menselijk IgG1-antilichaam ontwikkeld door AstraZeneca. Durvalumab is door de FDA goedgekeurd voor de behandeling van urotheelcarcinoom en niet-reseceerbare niet-kleincellige longkanker na chemoradiatie.
Experimenteel
Ten minste twee PD-L1-remmers bevinden zich in de experimentele ontwikkelingsfase.
- KN035 is het enige PD-L1-antilichaam met subcutane formulering dat momenteel klinisch wordt geëvalueerd in de VS, China en Japan
- CK-301 van Checkpoint Therapeutics
- AUNP12 is een 29-meer peptide als de eerste peptische PD-1 / PD-L1-remmer ontwikkeld door Aurigene en Laboratoires Pierre Fabre dat wordt geëvalueerd in een klinische proef, na veelbelovende in vitro resultaten.
- CA-170, ontdekt door Aurigene / Curis als de PD-L1- en VISTA-antagonist, werd aangeklaagd als een krachtige remmer van kleine moleculen in vitro De verbinding is dus momenteel in fase I klinische proef bij mesothelioompatiënten.
- BMS-986189 is een macrocyclisch peptide ontdekt door Bristol-Myers Squibb waarvan de farmacokinetiek, veiligheid en verdraagbaarheid momenteel wordt bestudeerd bij gezonde proefpersonen.
Bijwerkingen
Immuuntherapieën als groep hebben effecten buiten het doelwit en hebben gemeenschappelijke toxiciteit. Enkele hiervan zijn interstitiële pneumonitis, colitis, hepatitis, thyroïditis, huidreacties, laag aantal bloedplaatjes en witte bloedcellen, ontsteking van de hersenen of het ruggenmerg, neuromusculaire bijwerkingen waaronder myositis, Guillain-Barré-syndroom, myasthenia gravis; myocarditis en hartinsufficiëntie, acute bijnierinsufficiëntie en nefritis. De meest voorkomende niergerelateerde veranderingen zijn acute interstitiële nefritis, gevolgd door glomerulaire aandoeningen en vervolgens tubulaire schade. Het gedetailleerde mechanisme van deze nadelige effecten is niet volledig opgehelderd; ze verschillen echter duidelijk van bekende auto-immuunziekten. Immuungemedieerde bijwerkingen worden meestal toegeschreven aan gegeneraliseerde ontregeling van T-cellen of de ontwikkeling van auto-antilichamen, hoewel geheugen-T-celresponsen tegen occulte virale infecties ook een rol kunnen spelen bij sommige patiënten met gevorderd melanoom na gecombineerde PD-1 / CTLA-4-blokkade.
In vergelijking met standaard chemotherapeutica hadden PD-1 / PD-L1-remmers een lagere gerapporteerde incidentie van vermoeidheid, sensorische neuropathie, diarree, beenmergsuppressie, verlies van eetlust, misselijkheid en obstipatie.












Discussion about this post