| Alfa-amylase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
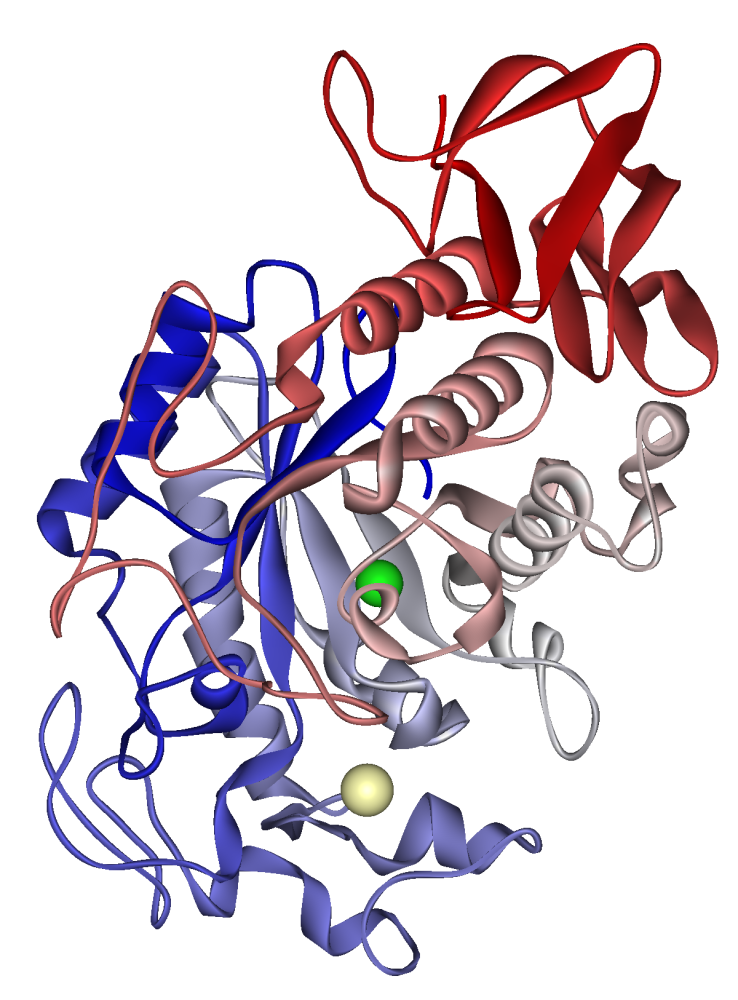
Menselijk speekselamylase: calciumion zichtbaar in bleek kaki, chloride-ion in groen. VOB 1SMD
|
|||||||||
| ID’s | |||||||||
| EG nr. | 3.2.1.0 | ||||||||
| CAS-nr. | 9000-90-2 | ||||||||
| Databases | |||||||||
| IntEnz | IntEnz-weergave | ||||||||
| BRENDA | BRENDA binnenkomst | ||||||||
| ExPASy | NiceZyme-weergave | ||||||||
| KEGG | KEGG-vermelding | ||||||||
| MetaCyc | metabolische route | ||||||||
| PRIAM | profiel | ||||||||
| VOB-structuren | RCSB VOB VOBe VOBsum | ||||||||
|
|||||||||
| GH13 katalytisch domein | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Cyclodextrine glucanotransferase (ec2.4.1.19) (cgtase)
|
|||||||||
| ID’s | |||||||||
| Symbool | Alfa-amylase | ||||||||
| Pfam | PF00128 | ||||||||
| Pfam-clan | CL0058 | ||||||||
| InterPro | IPR006047 | ||||||||
| SCOP2 | 1ppi / SCOPe / SUPFAM | ||||||||
| OPM-superfamilie | 117 | ||||||||
| OPM-eiwit | 1wza | ||||||||
| CAZy | GH13 | ||||||||
| CDD | cd11338 | ||||||||
|
|||||||||
| Alpha-amylase C-terminale beta-sheet-domein | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Kristalstructuur van gerst alfa-amylase isozym 1 (amy1) inactieve mutant d180a in complex met maltoheptaose
|
|||||||||
| ID’s | |||||||||
| Symbool | Alpha-amyl_C2 | ||||||||
| Pfam | PF07821 | ||||||||
| InterPro | IPR012850 | ||||||||
|
|||||||||
| Alfa-amylase, C-terminaal volledig bèta-domein | |||||||||
|---|---|---|---|---|---|---|---|---|---|
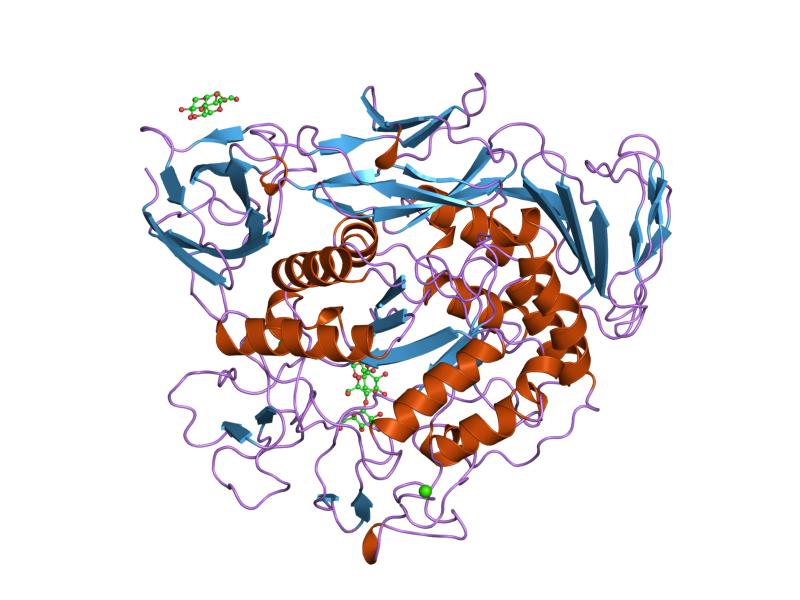
maltotriose-complex van voorgeconditioneerde cyclodextrineglycosyltransferasemutant
|
|||||||||
| ID’s | |||||||||
| Symbool | Alpha-amylase_C | ||||||||
| Pfam | PF02806 | ||||||||
| Pfam-clan | CL0369 | ||||||||
| InterPro | IPR006048 | ||||||||
| SCOP2 | 1ppi / SCOPe / SUPFAM | ||||||||
|
|||||||||
Alfa-amylase (α-amylase) is een enzym EC 3.2.1.1 dat alfa-bindingen van grote, alfa-gekoppelde polysacchariden, zoals zetmeel en glycogeen, hydrolyseert, wat kortere ketens daarvan, dextrines en maltose oplevert. Het is de belangrijkste vorm van amylase die bij mensen en andere zoogdieren wordt aangetroffen. Het is ook aanwezig in zaden die zetmeel bevatten als voedselreserve, en wordt uitgescheiden door veel schimmels. Het is een lid van de glycosidehydrolase-familie 13.
In de menselijke biologie
Hoewel amylase in veel weefsels wordt aangetroffen, is het het meest prominent in pancreassap en speeksel, die elk hun eigen isovorm van menselijk α-amylase hebben. Ze gedragen zich anders bij iso-elektrische focussering en kunnen ook worden gescheiden tijdens het testen door specifieke monoklonale antilichamen te gebruiken. Bij mensen linken alle amylase-isovormen aan chromosoom 1p21 (zie AMY1A).
Speekselamylase (ptyalin)
Amylase wordt aangetroffen in speeksel en breekt zetmeel af tot maltose en dextrine. Deze vorm van amylase wordt ook wel ‘ptyalin’ genoemd ˈtaɪəlɪn, die werd genoemd door de Zweedse chemicus Jöns Jacob Berzelius. De naam is afgeleid van het Griekse woord πτυω (ik spuug), omdat de stof werd verkregen uit speeksel. Het breekt grote, onoplosbare zetmeelmoleculen in oplosbare zetmelen (amylodextrine, erythrodextrine en achrodextrine) en produceert achtereenvolgens kleinere zetmelen en uiteindelijk maltose. Ptyalin werkt in op lineaire α (1,4) glycosidebindingen, maar hydrolyse van verbindingen vereist een enzym dat inwerkt op vertakte producten. Speekselamylase wordt in de maag geïnactiveerd door maagzuur. In maagsap ingesteld op pH 3,3 was ptyalin volledig geïnactiveerd in 20 minuten bij 37 ° C. Daarentegen bleef 50% van de amylaseactiviteit over na 150 minuten blootstelling aan maagsap bij pH 4,3. Zowel zetmeel, het substraat voor ptyaline, als het product (korte ketens van glucose) kunnen het gedeeltelijk beschermen tegen inactivering door maagzuur. Ptyalin toegevoegd aan buffer bij pH 3,0 onderging volledige inactivering in 120 minuten; toevoeging van zetmeel met een niveau van 0,1% resulteerde echter in dat 10% van de activiteit overblijft, en soortgelijke toevoeging van zetmeel tot een niveau van 1,0% resulteerde in ongeveer 40% van de activiteit die na 120 minuten bleef.
Optimale omstandigheden voor ptyalin
- Optimale pH – 7,0
- Menselijke lichaamstemperatuur
- Aanwezigheid van bepaalde anionen en activatoren:
- Chloride en bromide – het meest effectief
- Jodide – minder effectief
- Sulfaat en fosfaat – minst effectief
Genetische variatie in menselijke speekselamylase
Het speekselamylasegen heeft tijdens de evolutie duplicatie ondergaan en DNA-hybridisatiestudies geven aan dat veel individuen meerdere tandemherhalingen van het gen hebben. Het aantal genkopieën correleert met de niveaus van speekselamylase, zoals gemeten door middel van proteïne-blot-assays met behulp van antilichamen tegen humaan amylase. Het aantal genen wordt in verband gebracht met schijnbare evolutionaire blootstelling aan zetmeelrijke diëten. Een Japans individu had bijvoorbeeld 14 kopieën van het amylasegen (één allel met 10 kopieën en een tweede allel met vier kopieën). Het Japanse dieet bevat van oudsher grote hoeveelheden rijstzetmeel. Een Biaka-persoon daarentegen droeg zes exemplaren (drie exemplaren op elk allel). De Biaka zijn jagers-verzamelaars in het regenwoud die van oudsher een zetmeelarm dieet volgen. Perry en collega’s speculeerden dat het toegenomen aantal kopieën van het speekselamylase-gen de overleving mogelijk heeft verbeterd samenvallend met een verschuiving naar een zetmeelrijk dieet tijdens de menselijke evolutie.
Pancreasamylase
Pancreas α-amylase splitst willekeurig de α (1-4) glycosidebindingen van amylose om dextrine, maltose of maltotriose te geven. Het gebruikt een dubbel verplaatsingsmechanisme met behoud van de anomere configuratie. Bij mensen evolueerde de speekselamylase uit een kopie ervan.
In pathologie
De test voor amylase is gemakkelijker uit te voeren dan die voor lipase, waardoor het de primaire test is die wordt gebruikt om pancreatitis te detecteren en te controleren. Medische laboratoria meten gewoonlijk pancreasamylase of totaal amylase. Als alleen pancreasamylase wordt gemeten, wordt geen toename opgemerkt bij de bof of ander speekselkliertrauma.
Vanwege de kleine hoeveelheid die aanwezig is, is de timing echter van cruciaal belang bij het afnemen van bloed voor deze meting. Bloed moet kort na een aanval van pancreatitispijn worden afgenomen, anders wordt het snel door de nieren uitgescheiden.
Speeksel-α-amylase is gebruikt als een biomarker voor stress en als een surrogaatmarker van de activiteit van het sympathische zenuwstelsel (SNS) waarvoor geen bloedafname vereist is.
Interpretatie
Verhoogde plasmaspiegels bij mensen worden gevonden in:
- Speekseltrauma (inclusief anesthesie-intubatie)
- Bof – als gevolg van een ontsteking van de speekselklieren
- Pancreatitis – vanwege schade aan de cellen die amylase produceren
- Nierfalen – door verminderde uitscheiding
Totale amylasemetingen van meer dan 10 keer de bovengrens van normaal (ULN) duiden op pancreatitis. Vijf tot tien keer de ULN kan duiden op ileus- of duodenumaandoeningen of nierfalen, en lagere verhogingen worden vaak aangetroffen bij speekselklieraandoeningen.
Genen
- speeksel – AMY1A AMY1B AMY1C
- alvleesklier – AMY2A AMY2B
In graan
α-Amylase-activiteit in graan wordt gemeten door bijvoorbeeld het Hagberg-Perten Falling Number, een test om kiemschade vast te stellen, of de Phadebas-methode. Komt voor in tarwe.
Industrieel gebruik
α-Amylase wordt gebruikt bij de productie van ethanol om zetmeel in granen te breken tot fermenteerbare suikers.
De eerste stap bij de productie van maïssiroop met een hoog fructosegehalte is de behandeling van maïszetmeel met α-amylase, waarbij kortere ketens van suikersoligosacchariden worden geproduceerd.
Een α-amylase genaamd “Termamyl”, afkomstig van Bacillus licheniformis, wordt ook gebruikt in sommige wasmiddelen, met name vaatwasmiddelen en wasmiddelen voor het verwijderen van zetmeel.
Zie amylase voor meer toepassingen van de amylasefamilie in het algemeen.
Potentieel voor medisch gebruik
α-Amylase is doeltreffend gebleken bij het afbreken van polymicrobiële bacteriële biofilms door de α (1-4) glycosidebindingen te hydrolyseren in de structurele, matrix-exopolysacchariden van de extracellulaire polymere stof (EPS).
Bufferremming
Het tris-molecuul remt naar verluidt een aantal bacteriële α-amylasen, dus ze mogen niet in tris-buffer worden gebruikt.
Bepaling
Er zijn verschillende methoden beschikbaar voor het bepalen van de a-amylaseactiviteit, en verschillende industrieën hebben de neiging om op verschillende methoden te vertrouwen. De zetmeeljodiumtest, een ontwikkeling van de jodiumtest, is gebaseerd op kleurverandering, aangezien α-amylase zetmeel afbreekt en vaak in veel toepassingen wordt gebruikt. Een vergelijkbare maar industrieel geproduceerde test is de Phadebas-amylasetest, die wordt gebruikt als een kwalitatieve en kwantitatieve test in veel industrieën, zoals wasmiddelen, verschillende soorten meel-, graan- en moutvoedsel en forensische biologie.
Domeinarchitectuur
a-Amylasen bevatten een aantal verschillende eiwitdomeinen. Het katalytische domein heeft een structuur die bestaat uit een achtstrengige alfa / beta-cilinder die de actieve plaats bevat, onderbroken door een calciumbindend domein van ~ 70 aminozuren dat uitsteekt tussen beta-streng 3 en alfa-helix 3, en een carboxyl-terminale Griekse key beta-barrel domein. Verschillende alfa-amylasen bevatten een beta-sheet-domein, meestal aan het C-uiteinde. Dit domein is georganiseerd als een vijfstrengs antiparallelle beta-sheet. Verschillende alfa-amylasen bevatten een volledig bèta-domein, meestal aan het C-uiteinde.












Discussion about this post