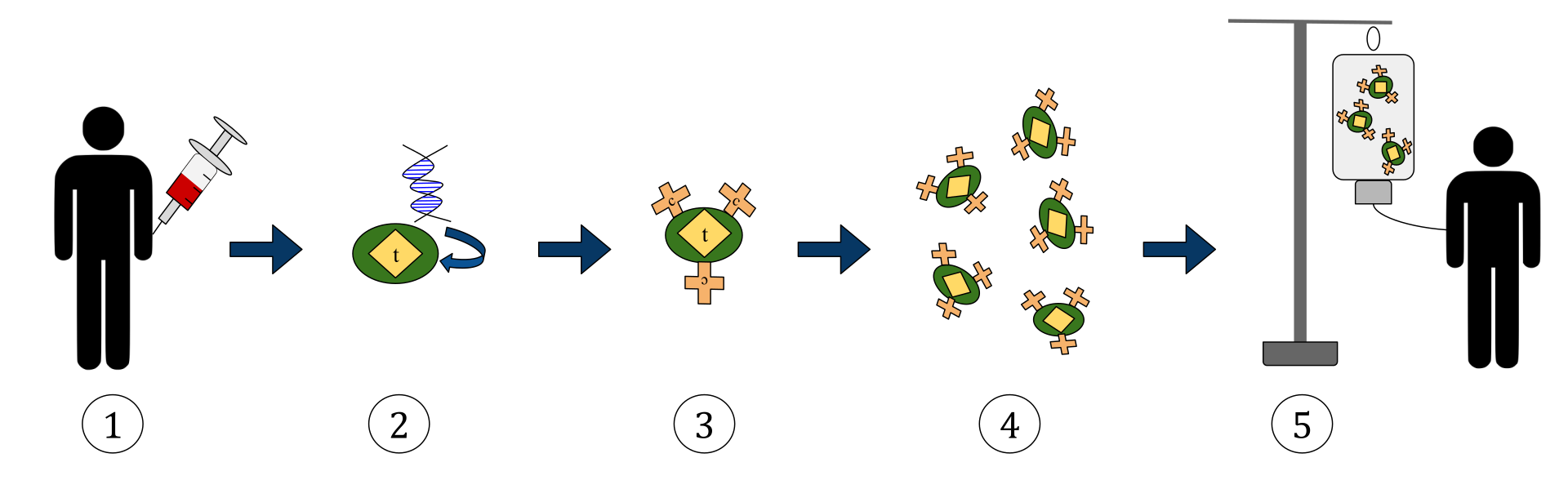
Het bovenstaande diagram geeft het proces van chimere antigeenreceptor T-celtherapie (CAR) weer. Dit is een methode van immunotherapie, die een groeiende praktijk is bij de behandeling van kanker. Het uiteindelijke resultaat moet een productie zijn van uitgeruste T-cellen die de geïnfecteerde kankercellen in het lichaam kunnen herkennen en bestrijden.
1. T-cellen (weergegeven door objecten met het label ’t’) worden uit het bloed van de patiënt verwijderd.
2. Vervolgens wordt in een laboratoriumomgeving het gen dat codeert voor de specifieke antigeenreceptoren in de T-cellen ingebouwd.
3. Op die manier produceren we de CAR-receptoren (aangeduid als c) op het oppervlak van de cellen.
4. De nieuw gemodificeerde T-cellen worden vervolgens verder geoogst en gekweekt in het laboratorium.
5. Na een bepaalde tijdsperiode worden de geconstrueerde T-cellen weer in de patiënt geïnfundeerd.
Chimerische antigeenreceptor T-cellen (ook gekend als CAR T-cellen) zijn T-cellen die genetisch zijn gemanipuleerd om een kunstmatige T-celreceptor te produceren voor gebruik bij immunotherapie.
Chimerische antigeenreceptoren (AUTO’S, ook gekend als chimere immunoreceptoren chimere T-celreceptoren, of kunstmatige T-celreceptoren) zijn receptoreiwitten die zijn ontworpen om T-cellen het nieuwe vermogen te geven om zich op een specifiek eiwit te richten. De receptoren zijn chimeer omdat ze zowel antigeenbindende als T-cel-activerende functies combineren tot een enkele receptor.
CAR-T-celtherapie maakt gebruik van T-cellen die zijn ontwikkeld met CAR’s voor kankertherapie. Het uitgangspunt van CAR-T-immunotherapie is om T-cellen aan te passen om kankercellen te herkennen om ze effectiever te richten en te vernietigen. Wetenschappers oogsten T-cellen van mensen, veranderen ze genetisch en geven vervolgens de resulterende CAR-T-cellen in patiënten om hun tumoren aan te vallen. CAR-T-cellen kunnen ofwel afkomstig zijn van T-cellen in het eigen bloed van een patiënt (autoloog) of afkomstig zijn van de T-cellen van een andere gezonde donor (allogeen). Eenmaal geïsoleerd uit een persoon, worden deze T-cellen genetisch gemanipuleerd om een specifieke CAR tot expressie te brengen, die ze programmeert om zich te richten op een antigeen dat aanwezig is op het oppervlak van tumoren. Voor de veiligheid zijn CAR-T-cellen zo ontworpen dat ze specifiek zijn voor een antigeen dat tot expressie wordt gebracht op een tumor die niet tot expressie wordt gebracht op gezonde cellen.
Nadat CAR-T-cellen bij een patiënt zijn geïnfuseerd, werken ze als een “levend medicijn” tegen kankercellen. Wanneer ze in contact komen met hun gerichte antigeen op een cel, binden CAR-T-cellen zich eraan en worden ze geactiveerd, gaan ze verder met prolifereren en worden cytotoxisch. CAR-T-cellen vernietigen cellen via verschillende mechanismen, waaronder extensieve gestimuleerde celproliferatie, waardoor de toxiciteit van andere levende cellen toeneemt (cytotoxiciteit) en door de verhoogde uitscheiding van factoren die andere cellen kunnen beïnvloeden, zoals cytokines, interleukines en groeifactoren.
Productie van CAR-T-cellen

De eerste stap bij de productie van CAR-T-cellen is het isoleren van T-cellen uit menselijk bloed. CAR-T-cellen kunnen worden vervaardigd uit het eigen bloed van de patiënt, bekend als een autologe behandeling, of uit het bloed van een gezonde donor, bekend als een allogene behandeling. Het fabricageproces is in beide gevallen hetzelfde; alleen de keuze van de initiële bloeddonor is anders.
Ten eerste worden leukocyten geïsoleerd met behulp van een bloedcelseparator in een proces dat bekend staat als leukocytenaferese. Mononucleaire cellen uit perifeer bloed (PBMC) worden vervolgens gescheiden en verzameld. De producten van aferese van leukocyten worden vervolgens overgebracht naar een celverwerkingscentrum. In het celverwerkingscentrum worden specifieke T-cellen gestimuleerd zodat ze actief zullen prolifereren en zich in grote aantallen zullen uitbreiden. Om hun expansie te stimuleren, worden T-cellen doorgaans behandeld met het cytokine interleukine 2 (IL-2) en anti-CD3-antilichamen.
De geëxpandeerde T-cellen worden gezuiverd en vervolgens getransduceerd met een gen dat codeert voor de gemanipuleerde CAR via een retrovirale vector, meestal een integrerende gammaretrovirus (RV) of een lentivirale (LV) vector. Deze vectoren zijn in de moderne tijd erg veilig vanwege een gedeeltelijke verwijdering van de U3-regio. De nieuwe tool voor het bewerken van genen CRISPR / Cas9 is onlangs gebruikt in plaats van retrovirale vectoren om het CAR-gen op specifieke plaatsen in het genoom te integreren.
De patiënt ondergaat lymfodepletiechemotherapie voorafgaand aan de introductie van de gemanipuleerde CAR-T-cellen. De uitputting van het aantal circulerende leukocyten in de patiënt reguleert het aantal geproduceerde cytokines en vermindert de concurrentie om hulpbronnen, wat helpt om de uitbreiding van de gemanipuleerde CAR-T-cellen te bevorderen.
Klinische toepassingen
Vanaf maart 2019 waren er wereldwijd ongeveer 364 lopende klinische onderzoeken met CAR-T-cellen. De meeste van die onderzoeken zijn gericht op bloedkankers: CAR-T-therapieën zijn goed voor meer dan de helft van alle onderzoeken naar hematologische maligniteiten. CD19 blijft het meest populaire antigeentarget, gevolgd door BCMA (vaak tot expressie gebracht bij multipel myeloom). In 2016 begonnen studies de levensvatbaarheid van andere antigenen, zoals CD20, te onderzoeken. Proeven voor solide tumoren worden minder gedomineerd door CAR-T, met ongeveer de helft van de op celtherapie gebaseerde onderzoeken waarbij andere platforms betrokken zijn, zoals NK-cellen.
Kanker
T-cellen zijn genetisch gemanipuleerd om chimere antigeenreceptoren tot expressie te brengen die specifiek gericht zijn op antigenen op de tumorcellen van een patiënt, en vervolgens in de patiënt worden gebracht waar ze de kankercellen aanvallen en doden. Adoptieve overdracht van T-cellen die CAR’s tot expressie brengen, is een veelbelovend antikankertherapie, omdat CAR-gemodificeerde T-cellen kunnen worden ontworpen om zich te richten op vrijwel elk tumor-geassocieerd antigeen.
Vroeg CAR-T-celonderzoek was gericht op bloedkankers. De eerste goedgekeurde behandelingen maken gebruik van CAR’s die zich richten op het antigeen CD19, aanwezig in van B-cel afkomstige kankers zoals acute lymfoblastische leukemie (ALL) en diffuus grootcellig B-cellymfoom (DLBCL). Er zijn ook pogingen gaande om CAR’s te ontwikkelen die zich richten op vele andere bloedkankerantigenen, waaronder CD30 bij refractair Hodgkin-lymfoom; CD33, CD123 en FLT3 bij acute myeloïde leukemie (AML); en BCMA bij multipel myeloom.
Vaste tumoren vormen een moeilijker doelwit. De identificatie van goede antigenen was een uitdaging: dergelijke antigenen moeten in hoge mate tot expressie worden gebracht op de meeste kankercellen, maar grotendeels afwezig in normale weefsels. CAR-T-cellen worden ook niet efficiënt verhandeld naar het centrum van vaste tumormassa’s, en de vijandige micro-omgeving van de tumor onderdrukt de T-celactiviteit.
Auto immuunziekte
Hoewel de meeste CAR T-celstudies zich richten op het creëren van een CAR T-cel die een bepaalde celpopulatie kan uitroeien (bijvoorbeeld CAR T-cellen die zich richten op lymfoomcellen), zijn er andere mogelijke toepassingen voor deze technologie. T-cellen kunnen ook zelf-antigenen beschermen tegen auto-immuunreacties. Een regulerende T-cel die is uitgerust met een CAR zou het potentieel kunnen hebben om tolerantie te verlenen voor een specifiek antigeen, iets dat zou kunnen worden gebruikt bij orgaantransplantatie of reumatische aandoeningen zoals lupus.
Satefy
Er zijn ernstige bijwerkingen die het gevolg zijn van de introductie van CAR-T-cellen in het lichaam, waaronder het cytokine-release-syndroom en neurologische toxiciteit. Omdat het een relatief nieuwe behandeling is, zijn er weinig gegevens over de langetermijneffecten van CAR-T-celtherapie. Er zijn nog steeds zorgen over de overleving van patiënten op de lange termijn, evenals over zwangerschapscomplicaties bij vrouwelijke patiënten die met CAR-T-cellen worden behandeld. Anafylaxie is een verwachte bijwerking, aangezien de CAR is gemaakt met een vreemd monoklonaal antilichaam en als gevolg daarvan een immuunrespons opwekt.
On-target / off-tumor-herkenning vindt plaats wanneer de CAR-T-cel het juiste antigeen herkent, maar het antigeen wordt tot expressie gebracht op gezond, niet-pathogeen weefsel. Dit resulteert erin dat de CAR-T-cellen niet-tumorweefsel aanvallen, zoals gezonde B-cellen die CD19 tot expressie brengen. De ernst van deze bijwerking kan variëren van B-celaplasie, die kan worden behandeld met ondersteunende infusies, tot extreme toxiciteit die tot de dood leidt.
Er is ook de onwaarschijnlijke mogelijkheid dat de gemanipuleerde CAR-T-cellen zelf zullen worden getransformeerd in kankercellen door insertiemutagenese, doordat de virale vector het CAR-gen in een tumoronderdrukker of oncogen in het genoom van de gastheer-T-cel inbrengt. Sommige retrovirale (RV) vectoren hebben een lager risico dan lentivirale (LV) vectoren. Beide hebben echter het potentieel om oncogeen te zijn. Genomische sequentieanalyse van CAR-insertieplaatsen in T-cellen is vastgesteld voor een beter begrip van de CAR T-celfunctie en persistentie in vivo.
Cytokine-afgiftesyndroom
Het meest voorkomende probleem na behandeling met CAR-T-cellen is het cytokine-release-syndroom (CRS), een aandoening waarbij het immuunsysteem wordt geactiveerd en een verhoogd aantal inflammatoire cytokines afgeeft. De klinische manifestatie van dit syndroom lijkt op sepsis met hoge koorts, vermoeidheid, spierpijn, misselijkheid, capillaire lekkage, tachycardie en andere hartstoornissen, leverfalen en nierinsufficiëntie. CRS komt voor bij bijna alle patiënten die met CAR-T-celtherapie worden behandeld; in feite is de aanwezigheid van CRS een diagnostische marker die aangeeft dat de CAR-T-cellen werken zoals bedoeld om de kankercellen te doden. Merk echter op dat een hogere graad van CRS-ernst niet correleert met een verhoogde respons op de behandeling, maar eerder met een hogere ziektelast.
Immuun-effectorcel-geassocieerde neurotoxiciteit
Neurologische toxiciteit wordt ook vaak geassocieerd met CAR-T-celbehandeling. Het onderliggende mechanisme is slecht begrepen en kan al dan niet verband houden met CRS. Klinische manifestaties zijn onder meer delirium, het gedeeltelijk verlies van het vermogen om coherent te spreken terwijl het nog steeds het vermogen heeft om taal te interpreteren (expressieve afasie), verminderde alertheid (obtundatie) en toevallen. Tijdens sommige klinische onderzoeken zijn sterfgevallen als gevolg van neurotoxiciteit opgetreden. De belangrijkste doodsoorzaak door neurotoxiciteit is hersenoedeem. In een studie uitgevoerd door Juno Therapeutics, Inc. stierven vijf patiënten die aan het onderzoek deelnamen als gevolg van hersenoedeem. Twee van de patiënten werden behandeld met alleen cyclofosfamide en de overige drie werden behandeld met een combinatie van cyclofosfamide en fludarabine. In een andere klinische studie, gesponsord door het Fred Hutchinson Cancer Research Center, was er één gemeld geval van onomkeerbare en fatale neurologische toxiciteit 122 dagen na de toediening van CAR-T-cellen.













Discussion about this post